Bilangan Kuantum
A.Bilangan Kuantum
Bilangan kuantum adalahsuatu harga yang menyatakan keadaan orbital suatu atom. Bilangan kuantum terdiri dari :
-Bilangan kuantum utama/prinsipal (n) : menyatakan tingkat energi/kulit atom
-Bilangan kuantum azimuth/orbital (l) : menyatakan sub kulit atom
-Bilangan kuantum magnetik (m) : menyatakan banyak dan posisi orbital
-Bilangan kuantum spin (s) : menyatakan kedudukan elektron dalam suatu orbital
1. Bilangan Kuantum Utama
Suatu harga yang menyatakan tingkat energi atau kulit dalam atom. Bilangan kuantum utama tidak pernah nol. Semakin tinggi nilai n semakin tinggi pula tingkat energinya.
Kulit
|
K
|
L
|
M
|
N
|
Bilangan
Kuantum Utama (n)
|
1
|
2
|
3
|
4
|
2. Bilangan Kuantum Azimuth
Suatu harga yang menyatakan subkulit atom dan bentuk geometri orbital. Nilai bilangan kuantum azimuth yaitu (n-1).
Sub kulit
|
Bilangan Kuantum Azimuth
|
s (sharp)
|
0
|
p ( principal)
|
1
|
d ( diffuse)
|
2
|
f ( fundamental)
|
3
|
3. Bilangan Kuantum Magnetik
Suatu harga yang menyatakan banyak dan posisi orbital. Nilai bilangan kuantum magnetik di setiap subkulitnya yaitu semua bilangan bulat mulai dari -l sampai +l termasuk 0
Subkulit
|
s
|
p
|
d
|
f
|
Harga
|
0
|
-1 sampai 1
|
-2 sampai 2
|
-3 sampai 3
|
Total
Orbital
|
1
|
3
|
5
|
7
|
Elektron
Maksimal
|
2
|
6
|
10
|
14
|
4. Bilangan Kuantum Spin
Suatu harga yang menyatakan kedudukan dan arah rotasi elektron pada suatu orbital. Ada 2 kemungkinan arah rotasi yaitu searah jarum jam dan berlawanan arah jarum jam. Searah dengan jarum jam ditandai dengan posisi panah keatas yang akan bernilai +1/2 dan berlawanan arah jarum jam ditandai dengan posisi panah kebawah yang akan bernilai -1/2
B. Bentuk Orbital
Bentuk orbital tergantung pada harga bilangan kuantum azimuth. Setiap nilai l nya memiliki bentuk orbital yang berbeda.
1. Orbital s
berbentuk satu buah balon/ bola
2. Orbital p
berbentuk satu buah balon yang dipilin atau dua bola
3. Orbital d
berbentuk dua buah balon yang dipilin
4. Orbital f
berbentuk empat buah balon yang dipilin / delapan balon
C.Diagram Orbital
Diagram orbital menggambarkan urutan konfigurasi elektron dalam setiap kulit atom. Konfigurasi elektron yang ditulis menggunakan bilangan kuantum harus memenuhi kaidah berikut :
1. Asas Aufbau
Elektron elektron mulai mengisi orbital dari tingkat energi terendah ke tingkat energi tertinggi. Orbital yang mempunyai tingkat energi yang paling rendah adalah 1s dilanjutkan dengan 2s 2p 3s3p dst.
2. Larangan Pauli
Tidak mungkin didalam atom terdapat 2 elektron dengan keempat bilangan kuantum sama. Hal ini berarti, bila ada 2 elektron yang mempunyai bilangan kuantum utama, azimuth, dan magnetik yang sama, maka bilangan kuantum spin nya harus berbeda
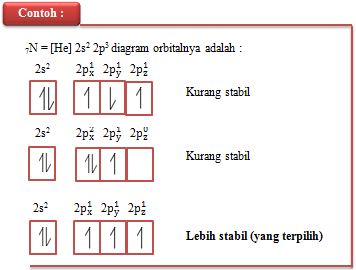
3. Aturan Hund
Pengisian elektron pada orbital suatu sub kulit, ialah bahwa elektron - elektron tidak membentuk pasangan elektron sebelum masing masing orbital terisi dengan sebuah elektron.
Referensi
Intan, A. (n.d.). Konfigurasi
Elektron. Retrieved September 5, 2019, from Academia:
https://www.academia.edu/11908580/KONFIGURASI_ELEKTRON
Setya, C. (n.d.). Bilangan
Kuantum. Retrieved September 5, 2019, from Academia:
https://www.academia.edu/8128511/Bilangan_kuantum








wah bagus bgt aku jadi pinter setelah membacanya
BalasHapusMakasih ya kak sangat bermanfaat, ditunggu postingan selanjutnya!
BalasHapusuda mulai baguss
BalasHapusWah aku jadi ketularan bisa kimia nih, makasih neng
BalasHapusKeren kak
BalasHapusSangat bermanfaat
BalasHapusSangat bermanfaat
BalasHapusBagus, sangat menambah wawasan👍
BalasHapusThanks, sangat membantu:)
BalasHapusSangat membantuu, terimakasih kak👍
BalasHapus👍👍👍
BalasHapusBagus banget kak
BalasHapusSangatt membantu👍
BalasHapus👍👍👍👍
BalasHapusPasti UN kimia jadi 100 kalo baca ini ��
BalasHapusMantapp cemangat kakakkkk❤
BalasHapusSngat membantu, makasih kk
BalasHapusTerimakasih
BalasHapusManteep
BalasHapusSangant membantu,,,
BalasHapussangat membantu kak
BalasHapusSangat membantu👍🏻
BalasHapusMntapp
BalasHapusbermanfaatt
BalasHapusSemangat terus kakk
BalasHapusbermanfaat dan sangat membantu :)
BalasHapusSangat bermanfaat
BalasHapusmembantu banget
BalasHapusBagus sekali penyajiannya, sangat bermanfaat 👍
BalasHapusBagus 👍
BalasHapusTerimakasih ya ini sangat membantu saya
BalasHapusSangat membantu :D
BalasHapus👍👍👍
BalasHapusTengss infonya, sangat membantu dan ringkas
BalasHapusBagus 👍
BalasHapusoohhh ternyata seperti itu ya
BalasHapusMenambah wawasan 😇😇
BalasHapusMantaap warbiyasaaaah
BalasHapusKren bu👍
BalasHapusmakasi kak nisa
BalasHapusSgt bermanfaat kak terimakasih
BalasHapuskak buat channel dong jelasin ttg inii suka bgt soalnya dgn penjelasan kakakk
BalasHapusbermanfaat👍🏻
BalasHapus👍👍👍
BalasHapusmakasih kak ,bermanfaat banget!
BalasHapusAlhamdulillah ya sumbernya tidak .com
BalasHapusNice..ditunggu postingan selanjutnyaa
BalasHapusSangat mudah dipahami.... Jangan lupa materi yg lain kak
BalasHapusWalaupun saya sudah lama tidak belajar kimia, tapi penjelasan ny sangat mudah dimengerti
BalasHapusMantap, padat singkat dan jelas.
BalasHapusbagus👍🏻
BalasHapusmakasihh kak sangatt membantuku mengerjakan pr yang diberi gurukuuu❤️✨✨
BalasHapussangat bermanfaat👍
BalasHapusMantul banget bahasannya
BalasHapusQntaps
BalasHapusAyoooo
BalasHapusMaterinya sangat membantu dan juga mudah dipahami, lanjutkan ����
BalasHapusSangat bermanfaat
BalasHapusSangat bermanfaat
BalasHapusSangat bermanfaat
BalasHapusMakasih ya kak,sangat membantu tugas" aku
BalasHapusMantappp mantapp
BalasHapusSngt brmnfaat
BalasHapusMateri yang di sajikan sangat membatu👍🏻
BalasHapussangat bermanfaat :)
BalasHapusTerimakasih, sngat bermanfaat👍
BalasHapusSangat bermanfaat terimakasih👍
BalasHapusBagus sangat membantu, materinya lengkap
BalasHapuspenjelasannya sangat jelas
BalasHapusniceee
BalasHapusMantapp kakk 👍🏻👍🏻
BalasHapusBagus bisa diambil manfaat
BalasHapusBagus kak
BalasHapusSangat Membantu
BalasHapuspembahasannya bagus :)
BalasHapusAlhamdulillah, makasih mba saya jdi ngerti kimia bab ini
BalasHapusGood,👍👍👍
BalasHapusTq kak
BalasHapusGood
BalasHapusMantep gan
BalasHapusGood
BalasHapusGood
BalasHapusSyukron
BalasHapus