Ikatan Kimia dan Unsurnya
A. Klasifikasi Ikatan
Jari Jari ionik
DAFTAR PUSTAKA :
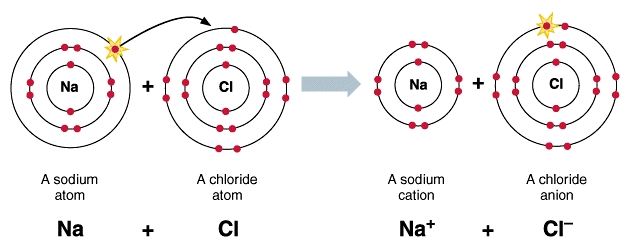
1. Ikatan Ion
Ikatan yang terbentuk sebagai akibat adanya gaya tarik menarik antara ion positif dan ion negatif.
Ciri ciri ikatan ion :
-Terjadi karena serah terima elektron (membentuk ion positif dan negatif)
-Terbentuk antara unsur logam dan nonlogam
-Mempunyai beda keelektronegatifan yang besar
Sifat sifat senyawa ion :
-Titik didih dan titik lelehnya tinggi
-Penghantar panas yang baik
-Keras, tetapi mudah patah
-Padatannya tidak menghantarkan listrik, tetapi lelehan maupun larutan nya dapat menghantarkan listrik
-Berwujud padat pada suhu kamar
-Larut dalam air, tetapi tidak larut senyawa senyawa organik seperti alkohol, benzena, eter
Contoh : NaCl
2. Ikatan Kovalen
Ikatan yang terjadi antara nonlogam dengan nonlogam dengan cara pemakaian bersama pasangan elektron. Adakalanya dua atom menggunakan lebih dari satu pasang elektron. Apabila yang digunakan bersama dua pasang atau tiga pasang elektron disebut ikatan kovalen rangkap dua dan rangkap tiga. Jumlah elektron valensi yang digunakan untuk berikatan tergantung pada kebutuhan tiap atom untuk mencapai konfigurasi elektron.
Sifat-sifat senyawa kovalen :
-Pada suhu kamar, umumnya berupa gas,cairan atau padatan dengan titik leleh rendah
-Gaya antarmolekul nya lemah meskipun ikatan kovalen merupakan ikatan yang kuat
-Larut dalam pelarut nonpolar
-Padatan, leburan atau larutannya tidak dapat menghantarkan listrik
Contoh : CO2
3. Ikatan Logam
Ikatan tarik menarik muatan positif dan negatif yang bergerak bebas di dalam logam. Ikatan logam berpengaruh terhadap titik leleh suatu logam. Semakin banyak elektron valensi maka ikatan logam smeakin kuat. Hal ini menyebabkan titik leleh logam semakin tinggi.
Sifat-sifat ikatan logam :
-Pada suhu kamar, umumnya berbentuk padatan
-Mengkilap
-Menghantarkan panas dengan baik
-Dapat ditempa dan dibentuk
-Dalam bentuk padat, atom atom logam tersusun dengan sangat rapat
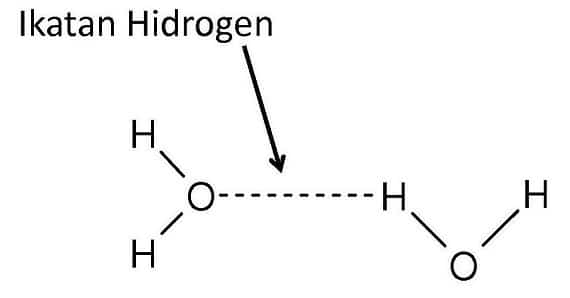
4. Ikatan Hidrogen
Gaya tarik menarik yang terjadi antara atom H dengan atom yang sangat elektronegatif yaitu F, O, N. Molekul yang dapat membentuk ikatan hidrogen antar molekul mempunyai titik didih yang tinggi
B. Faktor Geometri
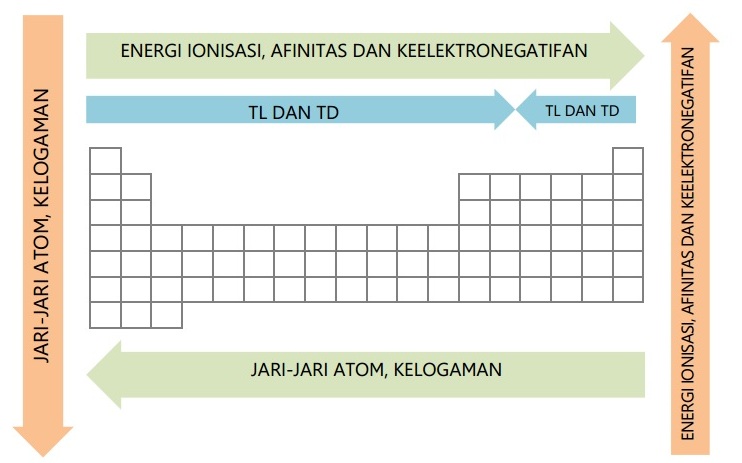
1. Jari jari atom dan ionik
Jari jari atom adalah jarak dari inti atom ke orbital elektron terluar. Terdapat beberapa jenis jari jari atom yaitu jari jari atom logam,kovalen,dan ionik. Jari jari atom logam yaitu separuh jarak antar inti atom, sedangkan jari jari atom kovalen yaitu separuh jarak atom logam antara 2 atom yang sama terikat secara bersama oleh ikatan kovalen,dan yang terakhir adalah jari jari ionik yaitu jarak antara 2 inti yang terhubung oleh ikatan elektrostatik antara kation dan anion. Dalam satu periode, jari jari semakin mengecil sedangkan dalam 1 golongan (atas ke bawah)
Jari jari atom adalah jarak dari inti atom ke orbital elektron terluar. Terdapat beberapa jenis jari jari atom yaitu jari jari atom logam,kovalen,dan ionik. Jari jari atom logam yaitu separuh jarak antar inti atom, sedangkan jari jari atom kovalen yaitu separuh jarak atom logam antara 2 atom yang sama terikat secara bersama oleh ikatan kovalen,dan yang terakhir adalah jari jari ionik yaitu jarak antara 2 inti yang terhubung oleh ikatan elektrostatik antara kation dan anion. Dalam satu periode, jari jari semakin mengecil sedangkan dalam 1 golongan (atas ke bawah)
Jari Jari ionik
2. Entalpi Kisi
Siklus Born-Haber adalah suatu pendekatan yang digunakan untuk menganalisa energi kisi. Untuk memutuskan ion ion bebas dari kisi membutuhkan energi yang besar. Nilai dari energi kisi bergantung pada kekuatan ikatan ion. Kekuatan ion berkaitan dengan ukuran muatan ion. contoh : pembentukan NaCl yang biasanya melepaskan kalor ke lingkungan
3. Tetapan Madelung
Energi potensial Coulomb total antar ion dalam senyawa ionik yang terdiri atas ion A dan B adalah penjumlahan energi potensial Coulomb interaksi ion individual, Vab. Karena lokasi ion-ion dalam kisi kristal ditentukan oleh tipe struktur, potensial Coulomb total antar ion dihitung dengan menentukan jarak antar ion d. A adalah tetapan Madelung yang khas untuk tiap struktur kristal
4. Struktur Kristal Logam
Logam seperti bahan lainnya, terdiri dari susunan atom-atom. Untuk lebih memudahkan pengertian, maka dapat dikatakan bahwa atom-atom dalam kristal logam tersusun secara teratur dan susunan atom-atom tersebut menentukan struktur kristal dari logam. Susunan dari atom-atom tersebut disebut cell unit. Susunan atom-atom dalam struktur kristal sangat menentukan sifat-sifat logamnya. Logam dengan struktur kristal BCC mempunyai kerapatan atom yang lebih rendah dibandingkan logam dengan struktur kristal FCC. Perbedaan kerapatan atom itu dapat dilihat dari jumlah bidang gesernya. Pada struktur kristal BCC, jumlah bidang gesernya lebih sedikit dari struktur kristal FCC, sehingga kemampuan atom-atom untuk bergeser lebih sulit.
5. Kristal ionik
Dalam kristal ionik, seperti logam halida, oksida, dan sulfida, kation dan anion disusun bergantian,
dan padatannya diikat oleh ikatan elektrostatik. Banyak logam halida melarut dalam pelarut polar
6. Aturan Jari Jari
Dalam bagian struktur yang terdiri hanya anion, anion membentuk koordinasi polihedral di
sekeliling kation. Jari-jari anion rX adalah separuh sisi polihedral dan jarak kation di pusat
polihedral ke sudut polihedral adalah jumlah jari-jari kation dan anion rX + rM. Polihedra dalam
CsCl adalah kubus, struktur NaCl adalah oktahedral, dan ZnS adalah tetrahedral. Jarak dari pusat ke sudut polihedral adalah berturut-turut √3rX, √2 rX dan ½√6rX
C. Faktor Elektronik
1. Muatan Inti Efektif
Muatan inti yang dirasakan oleh elektron valensi suatu atom dengan nomor atom Z akan lebih kecil dari muatan inti Ze. Penurunan ini disebut konstanta perisai dan muatan inti netto disebut dengan muatan inti efektif (Zeff)
2. Energi Ionisasi
Energi yang diperlukan untuk melepaskan elektron terluar suatu atom atau ion dalam wujud gas. Energi ionisasi pertama yang mengeluarkan elektron terluar merupakan energi yang paling rendah. Semakin mendekati inti maka energi yang diperlukan juga besar.
3. Afinitas Elektron
Perubahan energi atom ketika elektron ditambahkan kepada atom itu dalam keadaan gas. Berbeda dengan energi ionisasi, afinitas elektron dapat berharga positif atau negatif. Sehingga didefinisikan Afinitas elektron pertama adalah energi yang dilepaskan ketika 1 mol atom gas mendapatkan 1 elektron untuk membentuk 1 ion gas. Afinitas dapat dianggap sebagai entalpi ionisasi ion.
4. Keelektronegatifan
a) L. Pauling : " Keelektronegatifan merupakan parameter paling fundamental yang mengungkapkan secara numerik kecenderungan atom untuk menarik elektron dalam molekul." Skala pauling justfikasinya paling dekat yang mendefinisikan besaran kuantitatif karakter ion ikatan.
b)A.L Allerd dan E. G Rochow : "Keelektronegatifan merupakan medan listrik di permukaan atom."
hasilnya yaitu unsur unsur dengan jari jari kovalen yang kecil dan muatan inti efektif yang besar memiliki keelektronegatifan yang besar.
c)R. Mulliken : "Keelektronegatifan sebagai rata rata energi ionisasi dan afinitas elektron." (HOMO dan LUMO)
5. Orbital Molekul
Dalam pembentukan molekul, orbital atom bertumpang tindih menghasilkan orbital molekul yakni fungsi gelombang elektron dalam molekul. Jumlah orbital molekul adalah jumlah atom dan orbital molekul ini diklasifikasikan menjadi orbital molekul ikatan, non-ikatan, atau antiikatan sesuai dengan besarnya partisipasi orbital itu dalam ikatan antar atom. Kondisi pembentukan orbital molekul ikatan adalah sebagai berikut.
Syarat pembentukan orbital molekul ikatan:
(1) Cuping orbital atom penyusunnya cocok untuk tumpang tindih.
(2) Tanda positif atau negatif cuping yang bertumpang tindih sama.
(3) Tingkat energi orbital-orbital atomnya dekat.
(2) Tanda positif atau negatif cuping yang bertumpang tindih sama.
(3) Tingkat energi orbital-orbital atomnya dekat.
KESIMPULAN :
DAFTAR PUSTAKA :
Ariwibowo, I. S.
(2018). WANGSIT. Jakarta: PT Gramedia. Retrieved September 21, 2019
Makalah
klasifikasi ikatan dan faktor geometri. (2016, Januari 27).
Retrieved September 21, 2019, from Blogger:
http://makalahkimiaanorganikkelompok.blogspot.com/
Siregar, F.
(n.d.). Ikatan Kimia. Retrieved September 21, 2019, from Academia edu:
www.academia.edu/39347025/RPP_K13_Revisi_2016_KD_3.5_IKATAN_KIMIA_Untuk_SMA_Kelas_XI











tq infonya
BalasHapusMakasih kak ikaaaa sangat bermanfaat ditunggu postingan selanjutnya!
BalasHapushii mantap
BalasHapuswaahhh saya baru tahuu
BalasHapusThanks kak sangat membantu dan bermanfaat:)
BalasHapusNicee👍👍
BalasHapusBagus
BalasHapusBagus
BalasHapusKren
BalasHapusterimakasih
BalasHapustadi aku dikasi pr materi ini!!! makasih bgd lo kakkk
BalasHapusBaguss👍
BalasHapusIki apik
BalasHapusIki apik
BalasHapusBgusss
BalasHapusMantappp
BalasHapusTerimakasih kak, blognya sangat bermanfaat👍🏻👍🏻👍🏻
BalasHapusTq infonya roy jadi makin semangat belajrnya
BalasHapusSangat bermanfaat 👍 terimakasiih
BalasHapusBermanfaat. Trimaksih
BalasHapussemangat
BalasHapusNice,, thanks infonya, sngat bermanfaat
BalasHapusMateri kesukaanku ni wkwkkwkw thanks
BalasHapusMakasih banyak kakk, bermanfaat bangeett
BalasHapusMantqp
BalasHapusIni materi buat un kan ya??makasii
BalasHapusMantep kak ilmunya bermanfaat
BalasHapusBagus
BalasHapusSangat membantu kakk👍
BalasHapusmakasih kak sangat membantu pr saya disekolah
BalasHapusMakasih ya kakk
BalasHapusWah saya jadi semangat nih kak belajarnya
BalasHapusMaturnuwun mba...
BalasHapusbagus
BalasHapusSangat bermanfaat terimakasih
BalasHapusPenjelasan nya sangat lengkap
BalasHapusMantap
BalasHapusditunggu postingan selanjutnya
BalasHapusbagus kak
BalasHapusKeren bgt kak
BalasHapusmntap kak , bagusss
BalasHapusBagus kak, materi yang lain lagi kak
BalasHapusMateri yang di sajikan lengkap, sangat membantu
BalasHapusMantap KK warbiyasaah
BalasHapusbermanfaat kk 👍
BalasHapusGooodd
BalasHapuspembahasannya bagus :)
BalasHapusMantap kak
BalasHapusNice
BalasHapusSangat bermanfaat kak, mkasih
BalasHapusMantap kk
BalasHapusSangat bermanfaat. terima kasih :)
BalasHapusBagus
BalasHapusNice kakkk
BalasHapusasyap mantap
BalasHapusKeyeeenn
BalasHapusBagus bermanfaat
BalasHapus